Az eLitMed.hu orvostudományi portál a böngészés tökéletesítése érdekében cookie-kat használ.
Ha bővebb információkat szeretne kapni a cookie-k használatáról és arról, hogyan módosíthatja a beállításokat, kattintson ide: Tájékoztató az eLitMed.hu Cookie-használatáról.
Részletes keresés
Kérjük, állítsa be a paramétereket!
Találatok száma: 170
A neuromyelitis optica spektrumbetegség együttes előfordulása myastenia gravisszal és más autoimmun kórképekkel
Három eset bemutatása kapcsán szeretnék felhívni a figyelmet arra, hogy az egyébként ritka betegségnek számító neuromyelitis optica spektrumbetegség (NMOSD) szövődhet myasthenia gravisszal (MG). Szintén kiemelendő, hogy szisztémás lupus erithematosus (SLE), Sjögren-szindróma, rheumatoid arthritis fennállása esetén a differenciádiagnosztikát javasolt NMOSD irányába is kiterjeszteni – különösen akkor, ha három csigolyaszegmentum hosszú (vagy akár kiterjedtebb) myelitisre utaló gerinc-MR-eltérés vagy NMOSD-re jellegzetesnek tartható koponya-MR-eltérés jelentkezik.
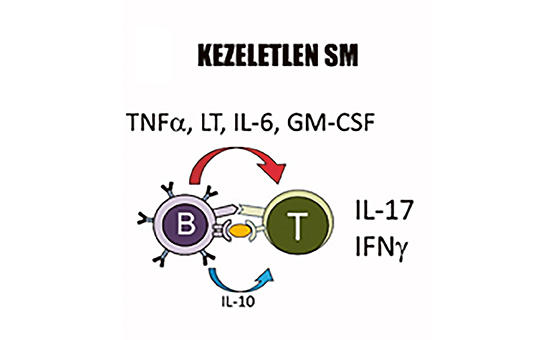
B-sejt-depletio a sclerosis multiplex terápiájában: új szereplő az ofatumumab
Az elmúlt évek kutatási eredményei bizonyították, hogy a B-lymphocyták döntő szerepet játszanak a sclerosis multiplex (SM) patogenezisében. A betegség folyamatának jobb megértése a B-sejteket célzó antitest-terápiák kifejlesztését eredményezte, amelyek potenciális gyógyszerek lehetnek mind a relapszusos, mind a progresszív SM formáiban. A B-sejt-depletiós terápiák ezért mindinkább előtérbe kerülnek, és meghatározóak a betegség progressziójának csökkentésében. Az első B-sejt-depletáló, anti-CD20 monoklonális antitest a rituximab volt, amit sclerosis multiplexben is vizsgáltak, és a kedvező eredményeket követően újabb gyógyszerek kerültek kifejlesztésre, hasonló támadásponttal. 2017-ben az FDA, 2018-ban az EMA is engedélyezte egy másik anti-CD20 monoklonális antitest, az ocrelizumab relapszáló-remittáló sclerosis multiplex (RRSM) és primer progresszív sclerosis multiplex (PPSM) terápiájában történő bevezetését. Ez különösen jelentős előrelépés volt a PPSM kezelésében, hiszen ez volt az első gyógyszer, ami bizonyítottan csökkentette a progressziót PPSM-ben. A B-sejt-depletiós terápia új szereplőjeként nemrégiben lépett színre az ofatumumab, ami egy teljesen humán anti-CD20 monoklonális antitest. A gyógyszer alkalmazását 2021 márciusában az EMA is engedélyezte a sclerosis multiplex relapszáló formáiban (RSM). Összefoglalónkban részletesen bemutatjuk a jelenleg SM-ben alkalmazott anti-CD20 monoklonális antitest-terápiák hatásmechanizmusát és hatékonyságát.
Idegtudományok
2022. MÁJUS 17.
Centrális vénajel a sclerosis multiplex képalkotó diagnosztikájában
A sclerosis multiplex (SM) diagnosztikáját jelentősen megnehezíti, hogy számos kórkép, mint például a migrén, bizonyos vascularis eltérések és egyéb gyulladásos megbetegedések, az SM-hez hasonló képet mutat. Az SM diagnosztikájában használt McDonald-kritériumrendszer az egyértelműen demyelinisatióra utaló esemény megléte esetén jól működik, ugyanakkor az atípusos, nonspecifikus vagy tünetmentes betegekben hibás SM-diagnózishoz vezethet, főleg, ha az MR-képanyag olyan eltéréseket mutat, melyek ismeretlen jelentőséggel bírnak. A centrális vénajel megfelelő határértékek megválasztása esetén magas specificitással bír az SM és az SM-utánzó kórképek differenciálásánál. A T2*-súlyozott szekvenciák alkalmazása tovább növelheti a jel szenzitivitását is.
Idegtudományok
2022. ÁPRILIS 29.
Az Epstein–Barr-vírus és a sclerosis multiplex
Régi feltételezés, hogy az Epstein–Barr-vírussal (EBV) történő megfertőződés indítja el a sclerosis multiplexet (SM) eredményező kórfolyamatot. Korábbi vizsgálatok az SM-es betegek 99,5%-ában emelkedett EBV-ellenes antitestszinteket mutattak ki, mely magasabb az egészséges populációban mért 94%-os értékhez képest. Egy mostanában publikált eredmény több mint 10 millió, az USA hadseregében 1993 és 2013 között szolgáló katonákból álló kohorszba tartozó 801 SM-es beteget vizsgált. A 801 beteg közül 35 kezdetben EBV-szeronegatív volt, az SM kezdete előtt közülük 34 beteg szeropozitívvá vált. A 801 SM-es beteg közül mindössze egy beteg volt EBV-szeronegatív az SM kezdetekor, mely meggyőző érv amellett, hogy az EBV valóban képes lehet elindítani az SM-hez vezető folyamatot.
Újdonságok az X-hez kötött hypophosphataemia diagnózisában és kezelésében
Az X-hez kötött hypophosphataemia (XLH) a foszfátanyagcsere veleszületett zavara. Patogenezise összetett, kórfolyamata a foszfáthomeosztázis, illetve a csontanyagcsere összehangolt szabályozási zavarához kötött. Összefoglalónkban áttekintjük a sokszínű manifesztációihoz vezető patofiziológiai sajátosságokat, a diagnosztika lépéseit és a kezelési lehetőségeket. Munkánk aktualitását a Magyarországon most bevezetésre kerülő burosumabkezelés adja, amely egy fibroblastnövekedési faktor-23-hoz (FGF-23) kötődő monoklonális antitest. Az XLH hátterében a ”phosphate regulating endopeptidase homolog, X-linked” (PHEX) gén funkcióvesztéses mutációi állnak, amely következtében a foszfátvesztést okozó FGF-23 szekréciója fokozódik. Diagnózisa az alábbi tünetegyüttes fennállása esetén állítható fel: rachitis és/vagy osteomalacia, hypophosphataemiával és (izolált) renalis foszfátvesztéssel, ami nem társul D-vitamin- vagy kalciumhiánnyal; továbbá meglassult növekedés, aránytalan törpenövés. Konvencionális kezelése per os foszfátpótlásból és párhuzamosan alkalmazott aktív D-vitaminból (kalcitriol vagy alfadiol) áll, amely javítja a csontanyagcserét, azonban az esetek többségében az elért eredmény csak részleges és mellékhatásokkal (nephrocalcinosis) is számolni kell. A PHEX gén, majd az FGF-23 szerepének tisztázása kijelölte a kórfolyamat befolyásolására alkalmas terápiás célpontokat. Ezek közül az FGF-23 ellen kifejlesztett monoklonális antitest terápia hatására a csontanyagcsere normalizálódik a kezelés során, az idejében megkezdett terápiával megelőzhetők az XLH során jelentkező szövődmények. Ugyanakkor a súlyos, mozgáskorlátozottságot okozó csontdeformitások teljes regressziója nem várható. Emiatt fontos, hogy a kezelést minél előbb, még azok kialakulása előtt megkezdjük.
[Hogyan kezeljük a terhesség alatt jelentkező MuSK-antitest-pozitív myastheniás krízist?]
[A myasthenia gravis (MG) a neuromuscularis junctio postsinapticus membránjában lévő acetilkolin-receptorok ellen létrejövő antitestekkel jellemezhető autoimmun betegség. A terhesség alatti betegséglefolyás nem jósolható meg. Az izomspecifikus tirozinkináz-receptor antitestekkel (anti-MuSK) jellemezhető MG-altípus lokalizáltabb klinikai karakterisztikummal bír és rosszabbul reagál a kezelésre, mint az acetilkolin-receptorok elleni antitestekkel jellemezhető altípus. Az anti-MuSK-pozitív myastheniás betegalcsoportban gyakoribb a myastheniás krízis (MC). Az anti-MuSK-pozitív MC kockázatos állapotot jelent terhesség alatt, és kezelése nagyon nehéz. A bemutatott esetben egy 30 éves, 9 hetes terhes, anti-MuSK-pozitív nőbeteg kezelését ismertetjük. A beteg a kórházunkba kerülését megelőző 6 hónapban, mivel terhességet tervezett, orvosa megkérdezése nélkül abbahagyta MG-ellenes kezelését. Az intenzív osztályon a beteget MC miatt hosszú ideig intubálták, és a kezelésre alig reagált. Terhességét magzati anomália miatt ez alatt az időszak alatt terminálták. Terápiája plazmaferézis, IVIg és immunszuppresszáns kezelés volt. 10 hetes kezelés után bocsátottuk otthonába. Esetbemutatásunkban részletesen ismertetjük kezelését.]
Idegtudományok
2021. NOVEMBER 11.
Klinikai döntéshozatal MOG antitest-asszociált betegségben
A szenzitív és specifikus sejtalapú esszék kifejlesztésével a humán myelin-oligodendrocyta glikoprotein (MOG) ellenes IgG-antitestek kimutatása lehetővé tette az anti-MOG antitest-asszociált betegség (anti-MOG antibody-associated disease, MOGAD) és az egyéb demyelinisatiós betegségek elkülönítését. A MOGAD, az aquaporin-4-asszociált neuromyelitis optica spektrum betegség (AQP4-NMOSD) és a sclerosis multiplex (SM) megkülönböztetését a betegségek különböző kórélettani háttere, klinikuma, terápiás és prognosztikus következményei egyaránt indokolják.
PML szokatlan etiológiával
A 41 éves nőbeteg kivizsgálása 1,5 hónapja progrediáló, felső végtagi túlsúlyú, enyhe hemiparesis miatt történt. A koponya-CT-n a felső kamrasíkban látszott fehérállományi hypodensitas, elsősorban sclerosis multiplex vagy térfoglalás gyanú merült fel. Koponya-MR során mindkét féltekében kiterjedt, konfluáló jellegű fehérállományi eltérés látszott. MR-morfológia alapján multifokális leukoencephalopathia gyanúja felmerült. A beteg kórelőzményében semmilyen korábbi betegség, gyógyszerszedés nem volt. Kiterjedt vírusszerológiai és liquorimmunológiai vizsgálat történt, PML-gyanú miatt liquor-JC-vírus-vizsgálat is, utóbbi pozitív eredményt hozott. A szteroid-lökéskezelés eredménytelen volt, neurológiai státuszban fokozatos romlást észleltünk. A kontroll- koponya-MR a folyamat jelentős progresszióját mutatta. A beteg többszöri, ismételt kikérdezése során derült ki, hogy 2 éve rendszeres plazmadonor Ausztriában és Magyarországon is. A Szent László Kórház Immundefektus Rendelésén történt ambuláns kivizsgálás, a feltárt alacsonyabb IgG-szint és a lymphocyta-fenotipizálás alapján CVID (common variable immunodeficiency) diagnózist állapítottunk meg. Immunológiai vélemény szerint a CVID önmagában nem magyarázza a PML-t, transzfúziós szakember szerint ezt plazmadonoroknál sem tapasztalták. Feltételezésünk szerint a két tényező együttes oki szerepe valószínűsíthető. Ismételten IVIG-kezelést kapott, ami eredménytelennek bizonyult. Pécsett történt agybiopszia a PML diagnózisát megerősítette. Körülbelül 5 hónapos betegséglefolyást követően betegünk elhunyt.
Új autoantitestek jelentősége a vékonyrost-neuropathiában – esetismertetés
38 éves férfi beteget vizsgáltunk 2021 tavaszán 4 éve tartó, egyre gyakrabban jelentkező, hirtelen testhelyzetváltozás által provokált szédülés miatt. Rosszullétei alkalmával pulzusa 180/perc, szisztolés vérnyomása 180-200 Hgmm körüli. Nyugalmi pulzusa 90-100/perc, vérnyomása nyugalomban fiziológiás. Többször fordult elő ájulás is. A végtagokban neuropathiás fájdalom jelentkezett. Fizikális vizsgálattal a végtagok distalis részén jelzett hypalgesián és melegre vonatkozó hypaesthesián kívül neurológiai kórjele nem volt. Panaszai megfeleltek posturalis orthostaticus tachycardia szindrómának (POTS), dysautonomiának. 2016-ban kullancscsípést követően Lyme-kórra jellegzetes bőrtünetei voltak. 2017-ben antibiotikum- terápiában részesült. 2018-ban Borrelia-IgGpozitív lett, antibiotikum-kezelést nem javasoltak, 2019-ben ismételt Borrelia-IgG-negatív volt. 2018-ban, 2019-ben többször vizsgálták gyomor-bél passzázszavar, abdominalis angina, illetve phaeochromocytoma gyanúja miatt negatív eredménnyel, az ekkor készült ENG negatív volt. 2020-ban németországi laborban anti-FGFR3 és anti-TS-HDS antitest-pozitív lett. 2021-ben az ismételt ENG-vizsgálat továbbra sem igazolt polyneuropathiát. A bőrbiopszia vékonyrost-neuropathiát igazolt, az intraepidermalis idegrostok száma jelentősen csökkent (0,3 rost/mm). A szokásos laborvizsgálatok mellett konfokális mikroszkópos corneavizsgálat, tilt table vizsgálat, autonóm idegrendszeri vizsgálat és lumbalpunctio is történt. Anti-FGFR3 és anti-TS-HDS-pozitív vékonyrostneuropathia miatt szteroidlökés-kezelést kezdtünk 2021 júniusában.
Paraneoplasia talaján kialakult myelopathia esete
Bevezetés: A malignus térfoglalásokhoz társuló, központi idegrendszert károsító paraneoplasias kórképek változatosak. Az immunmediált folyamatot a daganat által expresszált proteinek triggerelik. A specifikus antineuralis antitestek kimutatása megerősíti az etiológiát, de hiányuk nem zárja ki a folyamatot. Betegek és módszerek: 73 éves nő tüdőtumorhoz társuló myelitisesetét ismertetjük. Eredmények: Az anamnézisben tonsillectomia, appendectomia és alsó végtagi mélyvénás thrombosis ismert. 2014-ben a pajzsmirigy papillaris carcinomája miatt thyreoidectomiát, majd radiojód-kezelést végeztek. Rendszeres nyomon követés mellett a daganat kiújulására utaló jel nem volt. 2021 májusában mellkas- CT-felvételen a tüdő centrális térfoglalását vetették fel. Átvizsgálás során bronchofiberoszkópiával tumor indirekt jeleit találták, a kefecitológia szövettani eredménye negatív lett. 2021. júniusban haspuffadás, obstipatio, vizeletretenció, járási nehezítettség jelentkezett. A hasi panaszok hátterében a sebész subileust véleményezett. Fizikális vizsgálattal agyidegtünet nem volt, a jobb alsó végtag proximalis hajlító izmaiban latens paresis volt kétoldali pyramisjellel, mindkét alsó végtagon kifejezett ataxiával. Egyoldali segítséggel tudott csak járni. A thoracalis gerinc-MRI-felvétel alapján a Th I–X. csigolya közötti szakaszon myelitis, a Th XI–XII. csigolyaszintben pedig metasztázis lehetőségét vetették fel. A liquor víztiszta és színtelen, normális sejtszám- és glükózszint mellett az összprotein- és az albuminszint-emelkedett volt. A liquor-citopatológia negatív, a szérum-B12- és -folsav-szint normális tartományban volt; a szérumonkoneurális antitestek, az AQP4 és a MOG elleni antitest vizsgálata is negatív eredményű lett. A vírus- és bakteriális szerológia negatív lett vagy korábban átvészelt fertőzést igazolt. Szteroid-lökésterápia mellett a vegetatív panaszok megszűntek, a beteg járása is sokat javult. A Th XI–XII. csigolya magasságában lévő metasztázisra összesen 20 Gy sugárkezelést kapott. CT-vezérelt biopsziát végeztek, a szövettan tüdő-adenocarcinomát igazolt. A szteroid-lökésterápia mellett észlelt átmeneti javulást követően a beteg állapota rosszabbodott, súlyos paraparesis alakult ki vizeletretencióval, járásképtelenné vált. Következtetés: A paraneoplasiás myelopathia a gerincvelői betegségek ritka formája, sokszor a daganat felismerése előtt jelentkezik. Paraneoplasiás myelopathia gyanúja esetén tumorkutatást kell végezni. A tumor adekvát kezelése határozza meg a kimenetelt.
1.
2.
3.
Ideggyógyászati Szemle Proceedings
Egészségügyi szakmai irányelv az akut ischaemiás stroke diagnosztikájáról és kezeléséről4.
5.
1.
2.
Klinikai Onkológia
A rosszindulatú daganatok fenotípusának plaszticitása és az immunogén mimikri3.
Klinikai Onkológia
A szarkopénia mérése komputertomográfiával és jelentősége az onkológiai betegeknél4.
5.