Az eLitMed.hu orvostudományi portál a böngészés tökéletesítése érdekében cookie-kat használ.
Ha bővebb információkat szeretne kapni a cookie-k használatáról és arról, hogyan módosíthatja a beállításokat, kattintson ide: Tájékoztató az eLitMed.hu Cookie-használatáról.
Klinikai Onkológia - 2018;5(02)
Tartalom
Lágyrész-sarcomák korszerű gyógyszeres kezelése
Adjuváns kezelésként az ismert standard doxorubicin-monoterápia vagy a doxorubicin + ifoszfamid kombináció az elfogadott a legtöbb esetben. Letisztult irányelv még nem jött létre, azokban az esetekben javasolt az adjuváns kezelés, akiknek nagyobb, mint 10 cm méretű, high grade sarcomájuk volt, a műtét nem volt kellően radikális, illetve radioterápia sem jöhet szóba. A lokálisan előrehaladott tumorok esetében végtagmegtartás miatt izolált végtagi perfúzió javasolható. Új vegyületként a helyi kezelésben alkalmazható hefnium-oxid nanopartikulumok (NBTXR3) intratumorális befecskendezése és sugárkezeléssel való kombinációja lehet iránymutató, azonban további vizsgálatok szükségesek. Metasztatikus tumorok gyógyításában a standard terápia mellett egyre inkább előtérbe kerülnek a célzott, új kezelések: leiomyosarcomában a trabectedin mellett a pazopanib és az olaratumab; liposarcomában a trabectedin és az eribulin; synoviosarcomában a pazopanib; imatinibrezisztens GIST esetében a sunitinib és a regorafenib. A lágyrész-sarcomák heterogén szövettani altípusokba sorolhatók, ritka daganatok, amelyek kezelésében kulcsfontosságú a szövettani altípus szerinti kezelés, valamint az interdiszciplináris együttműködés az ortopéd sebésszel, a sugárterapeutával és a patológussal az egyénre szabott megfelelő terápia meghatározásáért.
A tüdőrák immunterápiája az újabb eredmények tükrében
Tíz évvel ezelőtt az előrehaladott stádiumú tüdőrák esetén, mind a kissejtes (SCLC), mind pedig a nem kissejtes (NSCLC) csoportban, a várható átlagos túlélés egy év körüli volt. Ez, sajnos, az SCLC esetén lényegileg mára sem változott. Az NSCLC kezelésében igazi forradalmi időszakot élünk át. A patológiai alcsoportokra specifikált kombinált citotoxikus kemoterápia mellett igen hosszú túléléssel kecsegtet a célzott terápia (EGFR-mutáció, ALK, ROS1, BRAF-pozitivitás esetén). Az SCLC vonatkozásában a klinikai gyakorlat tekintetében jelentős előrelépés a gyógyszeres kezelésben az utóbbi harminc évben nem történt. Az újabb terápiás lehetőség NSCLC fennállásakor előrehaladott stádiumban az immunellenőrzőpont-gátló terápia, amely három éve már a klinikumban is a komplex kezelés része, hazánkban is. A PD1, a PDL1 és a CTLA4-gátló vegyületek beépítése a terápiás gyakorlatba igazi, új kihívás. Előrehaladott stádiumú NSCLC fennállásakor, magas PDL1-expresszió esetén, első vonalban új standard a pembrolizumab-monoterápia. Második vonalban mind a pembrolizumab, mind a nivolumab, mind pedig az atezolizumab evidenciaalapon adható. Az NSCLC-betegek mintegy harmadát kitevő lokálisan kiterjedt esetekben a radiokemoterápia után alkalmazott konszolidációs fenntartó durvalumab terápia új hatékony lehetőség. Az eddigi gyógyszeres terápiás nihilizmus az SCLC esetén oldódni látszik. Az antitestgyógyszerkonjugátummal végzett terápia alkalmazásának lehetősége már a közeljövőben a klinikumban is várható. A nivolumab, illetőleg a nivolumab + ipilimumab kombináció szintén ígéretes eredményekkel kecsegtet SCLC másod-, illetőleg többedvonalbeli kezeléseként. A biomarker-szelekción alapuló kezelési terv mind NSCLC, mind pedig SCLC esetén részben gyakorlat, részben kutatási irány (például PDL1-expresszió, szomatikus mutációs arány [TMB], DLL3, cMyc stb.). A különböző gyógyszeres kezelési modalitások egyedi alkalmazása helyett az okos, biomarker-szelekción alapuló komplex terápiás stratégia segíthet e betegség eddigi szerény terápiás eredményeinek javításában, krónikus betegséggé való formálásában.
Tumorellenes vakcináció
Annak ellenére, hogy a daganatellenes immunterápiát először William Coley vezette be egy évszázaddal ezelőtt, a tumorellenes vakcináció mind a mai napig kezdeti fázisban van. Az utóbbi időben mind a celluláris, mind a molekuláris immunológia terén olyan aktivitás jött létre, amely segített az immunrendszer és a daganatos sejtek közti interakció pontosabb megértésében. Preklinikai és klinikai vizsgálatokból származó számos adat támasztja alá a tumorellenes vakcinációk azon tulajdonságát, hogy képesek olyan immunválaszt kiváltani, amely daganatspecifi kus és néhány esetben klinikai választ is eredményez. Cikkünkben igyekszünk áttekinteni a jelenleg fejlesztés alatt álló, valamint klinikai vizsgálati fázisban levő tumorellenes vakcinációs lehetőségeket.
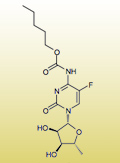
A fluoropirimidinek melletti kardiotoxicitás
A tradicionális kemoterápiás szerek egyik leghatékonyabb családját a fluoropirimidinek jelentik. Számos daganattípus eredményes kezelése azonban, mint más citotoxikus szer esetében, különböző szervek toxicitását okozhatja, amely a kezelés leállításához is vezethet. Ez az áttekintés a fluoropirimidinek kardiotoxicitását elemzi irodalmi adatok és saját tapasztalatok alapján. A kardiotoxicitás igen széles határok között jelenik meg, követése a kezelés tartama alatt folyamatos ellenőrzést és szükség esetén beavatkozást igényel.
Fúziók szolid tumorokban
A genetikai fúziók a genomikai átrendeződés következtében alakulnak ki. Ide tartozik a kromoszomális inverzió, az interstitialis deletio, az amplifikáció vagy a transzlokáció. Mindezek képesek befolyásolni a daganatok keletkezését és progresszióját. A fúziókat először hematológiai tumorokon mutatták ki (például BCR-ABL), de megjelentek szolid tumorokban is, a technikák függvényében. Nagy érzékenységű szekvenátorral nyert adatokból kiderült, hogy fúziók ritkán fordulnak elő, ezen belül is kevés az onkogénként viselkedők aránya, a többi passenger, ami magyarázza a fals pozitív esetek nagy számát. Néhány fúzió, mint driver mutáció, terápiás célpontként való alkalmazását (ALK, ROS1, PDGFB) engedélyezte az FDA. Mint más célpontok kezelésénél, rezisztencia alakulhat ki, amelyet második és harmadik generációs szerekkel próbálnak meg kivédeni.
A malignus eredetű testüregi folyadékok kezelése
A malignus eredetű testüregi folyadékok etiológiája változatos, és bár vannak jellemző daganattípusok, hátterükben gyakorlatilag bármilyen daganatos betegség állhat. Összességében a testüregi folyadék megjelenése egy progrediáló betegségre utal, a prognózist a tumor típusa, a daganatellenes kezelésre való reakciója és a beteg állapota nagyban befolyásolja. Az esetek nagy részében a testüregi folyadékgyülemek kezelése palliatív jellegű, amelynek célja a tünetek csökkentése és az életminőség javítása. Természetesen vannak kivételek, például a pericardialis tamponád. Megfelelő kezeléssel a betegek tünetei egyensúlyban tarthatók, így a szükséges hospitalizációk száma minimalizálható. Összefoglalásként elmondhatjuk, hogy a megfelelő terápia megválasztásánál a beteg általános állapotát, életkilátásait, a kontraindikációkat, a lehetséges szövődményeket, a költséghatékonyságot kell fi gyelembe venni a beteg egyéni igényeit és kéréseit is tiszteletben tartva, a lehetséges alternatívákról való pontos informálással.
Malignus daganatos megbetegedések okozta neurológiai kórképek
Az onkológiai betegségek okozta neurológiai tünetek, tünetegyüttesek egy szerteágazó etiológiájú heterogén klinikai entitás, amely érintheti a központi és perifériás idegrendszert, lehet primer vagy szekunder, de létrejöhet akár immunmediált folyamatok útján is. Összefoglaló cikkünkben áttekintjük az onkológiai gyakorlatban előforduló neurológiai kórképeket és vezető tüneteket. Kiemelten tárgyaljuk a háttérben álló leggyakoribb daganatként az agyi metasztázisokat, amelyek jelenleg az új célzott és immunterápiák fókuszpontjába kerültek, s napjainkban is egyre bővül azon szerek köre, amelyek intracranialis aktivitást mutatnak. Részletezzük a daganatok okozta paraneoplasiás neurológiai szindrómákat, mert bár ritkák, de egyre jobban diagnosztizálhatók, és gyors felismerésük elengedhetetlen a háttérben álló daganatos folyamat detektálásában. Végül a tumorok kezelésének mellékhatásaként újabban megfi gyelhető neurológiai tüneteket ismertetjük, mint a PD1-gátló immunterápiák következtében közel 3%-ban fellépő neurológiai szövődmények. Nem megfeledkezve a kemoterápiák okozta polyneuropathiákról és a tüneti terápiaként alkalmazott antikonvulzív terápiás indikációkról.
1.
2.
3.
Ideggyógyászati Szemle Proceedings
Egészségügyi szakmai irányelv az akut ischaemiás stroke diagnosztikájáról és kezeléséről4.
5.
1.
2.
3.
4.
5.