A szerotonin nem csak neurotranszmitter
2019. ÁPRILIS 24.
2019. ÁPRILIS 24.
Szöveg nagyítása:
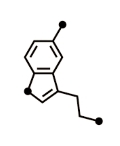
A szerotonin nemcsak ingerületátvivőként működik, de a génexpresszió szabályozásában is részt vesz. E felfedezés következtében jobban megérthetjük a normál agyfejlődést, a pszichiátriai és neurodegeneratív betegségeket, és új terápiás módszereket fejleszthetünk ki. A felfedezés, miszerint a szerotonin nemcsak neurotranszmitterként működik, hanem a génexpresszió szabályozásában is részt vesz, drámai fejlemény, hiszen alapjaiban módosítja az eddig érvényes dogmát, nyilatkozta a felfedezéshez vezető munkát irányító Ian Maze, a Icahn School of Medicine at Mount Sinai idegkutatója. A Nature-ben megjelent kutatás eredményeképpen jobban megérthetjük az agyi betegségek, a hangulatzavarok és függőségek, valamint a neurodegeneratív betegségek kialakulását egyaránt. Az eddig érvényben lévő dogma azon az elképzelésen alapult, hogy a különböző neurotranszmitterek – így pl. a szerotonin vagy a dopamin – az idegsejtek membránreceptorainak aktiválása révén működnek, a sejtfelszíni receptorokhoz kötődve szabályozzák a sejtek aktivitását. A szerotonin többek között részt vesz a hangulatszabályozásban, és számos olyan gyógyszer van forgalomban, ami az ingerületátvivő szinaptikus koncentrációját növelve befolyásolja a hangulatot (szelektív szerotoninvisszavétel-gátlók). A számos kutatóintézet együttműködésében végrehajtott munka most feltárta: a szerotoninnak az ingerületátviteltől független hatása is van. A Princeton University, a Tsinghua University, a University of Pennsylvania, a Salk Institute for Biological Sciences, a Rockefeller University és a Max Delbrück Center for Molecular Medicine idegkutatóiból álló csapat felfedezte, hogy a szöveti transzglutamináz 2 nevű enzim (TGM2) képes arra, hogy a szerotonint a sejtmagban található hisztonfehérjékhez kapcsolja. A hiszton-szerotoniláció következtében fellazul a DNS szerkezete, és az adott területen lehetővé válik a gének átíródása. A kutatók a hiszton-szerotoniláció génexpresszió-fokozó hatását rágcsálók agyában és humán neuronokban egyaránt kimutatták. A kutatók hozzáteszik: elképzelhető, hogy a szerotoninhez hasonlóan más monoamin „neurotranszmitterek” is rendelkeznek egyéb funkcióval. A felfedezés kapcsán számos kérdésre kell majd választ adni, így pl. a következőkre: Hogyan befolyásolja az agyműködést a szerotonin génexpresszióra kifejtett hatása? Közreműködik-e a szerotonin génexpresszióra kifejtett hatása a hangulatszabályozásban? Lehet-e új gyógyszereket kifejleszteni a hiszton-szerotoniláció befolyásolása révén? Képes-e a függőségek kialakulásában közreműködő neurotranszmitter, a dopamin is hisztonfehérjékhez kapcsolódni, és befolyásolni a génexpressziót? Melyek a protein-monoaminiláció funkcionális következményei? Mi a hiszton-szerotoniláció funkciója az agyon kívül jelentős mennyiségű szerotonint termelő másik szervben, a vastagbélben? Mint az idegkutatók tanulmányukban írják, néhány korábbi vizsgálat hívta fel a figyelmüket arra, hogy bár a szerotonin működéséhez alapvető a molekula vezikulumokba csomagolása, a szerotonin extravezikulárisan, a monoamin-termelő sejtek magjában és sejttestében is jelen van. Az is kiderült korábban, hogy a TGM2 segítségével a szerotonin a sejtplazmában képes kovalens kötéssel fehérjékhez kötődni, ezért a kutatók megvizsgálták, bekövetkezik-e ez a sejtmagban is. Mint kiderült, a szerotonin hozzákapcsolódik a sejtmagi fehérjékhez is, és a várakozással ellentétben a hiszton-szerotoniláció nem korlátozódik a szerotinin-termelő sejtekre, továbbá az az agyon és a vastagbélben kívül a szívben, a perifériás vér mononukleáris sejtjeiben és a herékben is bekövetkezik. Kiderült továbbá, hogy a hiszton-szerotoniláció igen jelentős a pluripotens őssejtekben, miközben azok szerotonin-termelő idegsejtekké alakulnak; hiszton-szerotoniláció hiányában zavart szenved az idegsejtek érése és axonjuk kifejlődése. Összefoglalójukban a kutatók hangsúlyozzák: bebizonyosodott, hogy a speciális promoter régiókban bekövetkező szerotoniláció hatására fokozódik a génexpresszió, így alapvetően módosítanunk kell a szerotonin biológiai aktivitásával kapcsolatos nézeteinket. Eredeti közlemény: Farrelly LA, Thompson RE, Zhao S, Lepack AE, Lyu Y, Bhanu NV, Zhang B, Loh YE, Ramakrishnan A, Vadodaria KC, Heard KJ, Erikson G, Nakadai T, Bastle RM, Lukasak BJ, Zebroski H 3rd, Alenina N, Bader M, Berton O, Roeder RG, Molina H, Gage FH, Shen L, Garcia BA, Li H, Muir TW, Maze I. Nature. 2019 Mar;567(7749):535-539. doi: 10.1038/s41586-019-1024-7. Histone serotonylation is permissive modification that enhances TFIID binding to H3K4me3. dr. Kovács Bence eLitMed.hu 2019. 04. 24.
Idegtudományok
A kábítószerélvezet valószínűleg a „gondolkodás nélküli cselekvés” veleszületett hajlamához köthető. Legalábbis ezt mutatták ki a kutatók mesterséges stimulánst használó testvérek vizsgálata alapján.
Idegtudományok
Kutatók egy új terápiás eljárást ismertettek, mellyel csökkenthetőek az agyi infartus okozta károsodások, az elhalt idegek újra növekedhetnek, a kiesett működések helyreállhatnak. Ráadásul az eddigiekkel szemben „a terápia hosszú idővel a stroke után is hatékony” - állítja Gwendolyn Kartje, a cikk első szerzője.
Idegtudományok
A vizsgálat eredménye szerint kevés bizonyíték szól a szteroidok használata mellett akut neuritis vestibularis esetén. A meglévő bizonyítékok alapján a klinikailag fontos kimenetelek és az objektív vestibularis funkciós kimenetelek között nincs szoros kapcsolat: a DHI-skálán mért rokkantságban egy hónap múlva nem volt szignifikáns különbség a placebo és a szteroid között, a kalorikus tesztek ugyanakkor jobb vestibularis funkciót mutattak ugyanebben az időpontban a szteroiddal kezelt betegek körében. Megjegyzendő, hogy a kalorikus teszt a lateralis (horizontális) félkörös ívjárat, így az ezt beidegző nervus vestibularis superior működéséről ad információkat, a neuritis vestibularisban ugyanakkor a nervus vestibularis inferior is érintett lehet, noha ennek izolált érintettsége csupán az esetek 2,3%-ában igazolható.
A Molecular Psyhiatry folyóiratban megjelent közlemény szerzői ezért átfogó áttekintésben (umbrella review) néztek utána valamennyi fellelhető bizonyítéknak, és értékelték az általuk felhasznált szisztematikus áttekintések és metaanalízisek minőségét is (az átfogó áttekintések a kutatási kérdés szempontjából releváns, meglévő szisztematikus áttekintéseket és metaanalíziseket vizsgálják, és a rendelkezésre álló bizonyítékok szintézisének egyik legmagasabb szintjét képviselik). A téma teljes körű lefedése érdekében egy nagy esetszámú genetikai vizsgálatot is bevontak az értékelésbe.
Idegtudományok
A szenzitív és specifikus sejtalapú esszék kifejlesztésével a humán myelin-oligodendrocyta glikoprotein (MOG) ellenes IgG-antitestek kimutatása lehetővé tette az anti-MOG antitest-asszociált betegség (anti-MOG antibody-associated disease, MOGAD) és az egyéb demyelinisatiós betegségek elkülönítését. A MOGAD, az aquaporin-4-asszociált neuromyelitis optica spektrum betegség (AQP4-NMOSD) és a sclerosis multiplex (SM) megkülönböztetését a betegségek különböző kórélettani háttere, klinikuma, terápiás és prognosztikus következményei egyaránt indokolják.
Hírvilág
Following the success of the previous Epigenetic Conferences in Budapest (2012 and 2014) we are delighted to announce that the next Danube Conference on Epigenetics will be held on 5-8 October, 2016 again in Budapest.
Összefüggést találtak a gyermekkori súlyos bántalmazás vagy elhanyagolás és egy glükokortikoid-receptor megváltozott expressziója, génjének inaktiválódása között öngyilkosok hippocampusát vizsgálva. Ez a receptor felelős a tartós stressz miatti fokozott kortizoltermelődés korlátozásáért.
COVID-19
A Covid-19-ről szóló beszámolók a betegség súlyosságától függően, tünetileg leggyakrabban a lázat, a fáradtságot, a száraz köhögést, az izomfájdalmat és a légszomjat említik. Ugyanakkor a szerzők tudomása szerint eddig csak egy tanulmány foglalkozott Covid-19 fertőzötteknél a szag- vagy ízérzékelésben bekövetkezett változásokkal, és 34%-os prevalenciát állapítottak meg a kórházban kezeltek körében. Viszont a tanulmány nem közölt adatot a megváltozott érzékelés idejéről és a többi tünethez való viszonyáról.
1.
2.
3.
4.
Ideggyógyászati Szemle Proceedings
Egészségügyi szakmai irányelv az akut ischaemiás stroke diagnosztikájáról és kezeléséről5.
1.
2.
Klinikai Onkológia
A rosszindulatú daganatok fenotípusának plaszticitása és az immunogén mimikri3.
Klinikai Onkológia
A szarkopénia mérése komputertomográfiával és jelentősége az onkológiai betegeknél4.
5.
HOZZÁSZÓLÁSOK
0 hozzászólás